


































Σπυροπούλου-Βλάχου Μαίρυλιν
Γλώσσα
Ελληνική
Ημερομηνία
02/12/2013
Διάρκεια
40:51
Εκδήλωση
Διάλογοι Ελλήνων Νευροεπιστημόνων για την Ανοσογενετική της Σκλήρυνσης κατά Πλάκας
Χώρος
Ίδρυμα Ευγενίδου
Διοργάνωση
Μαρία Αναγνωστούλη
Ελληνική Εταιρεία Νευροεπιστημών
Ελληνική Εταιρεία Ανοσολογίας (ΕΕΑ)
Κατηγορία
Ανοσολογία, Νευροεπιστήμες
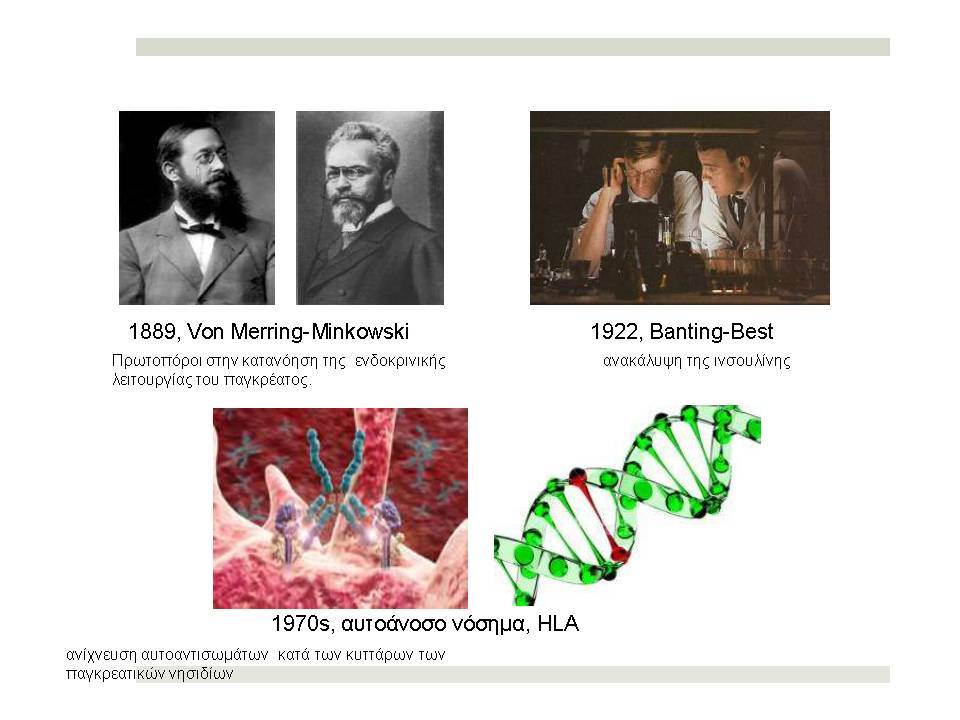
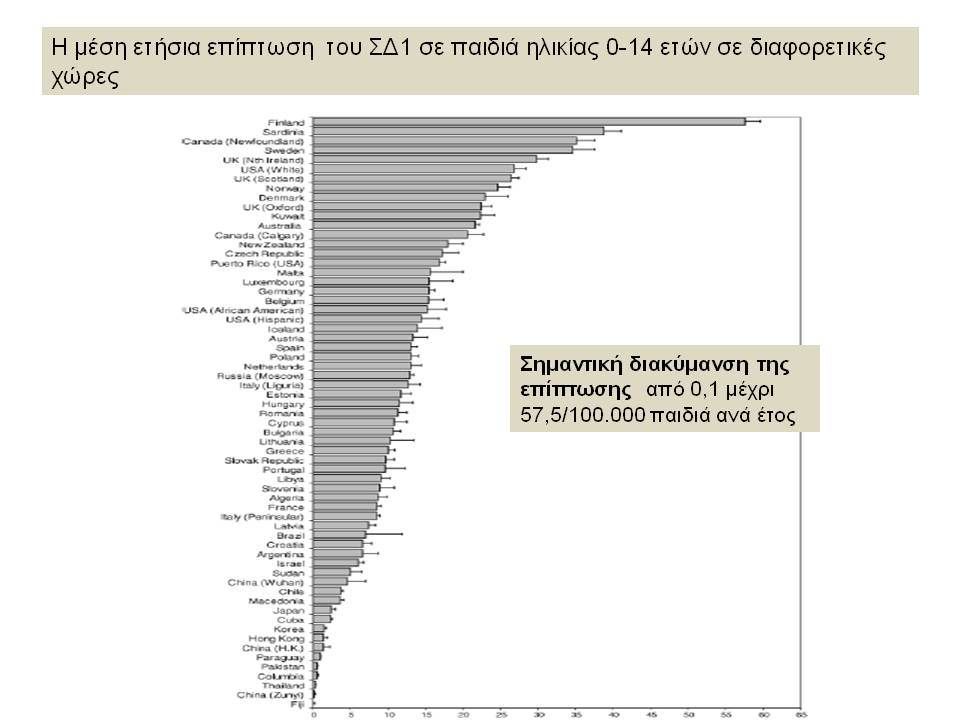
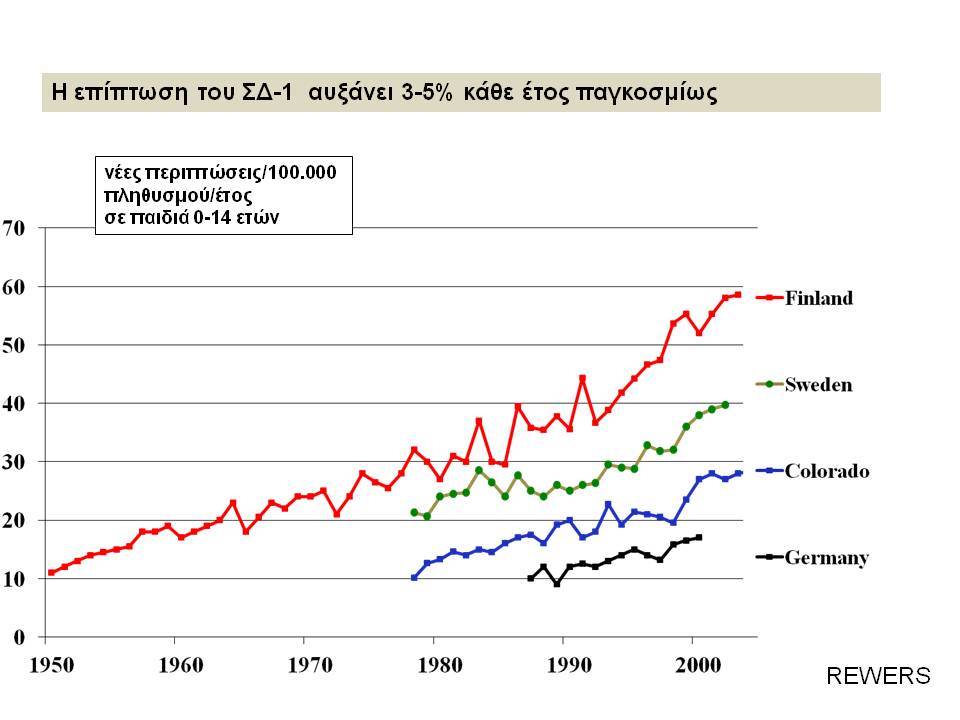
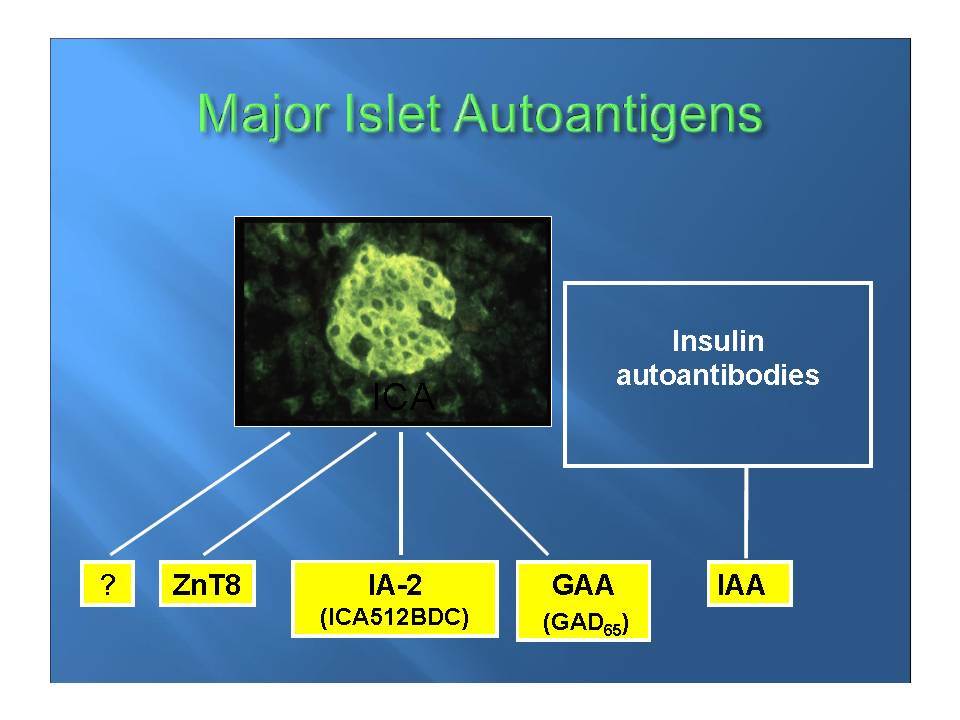
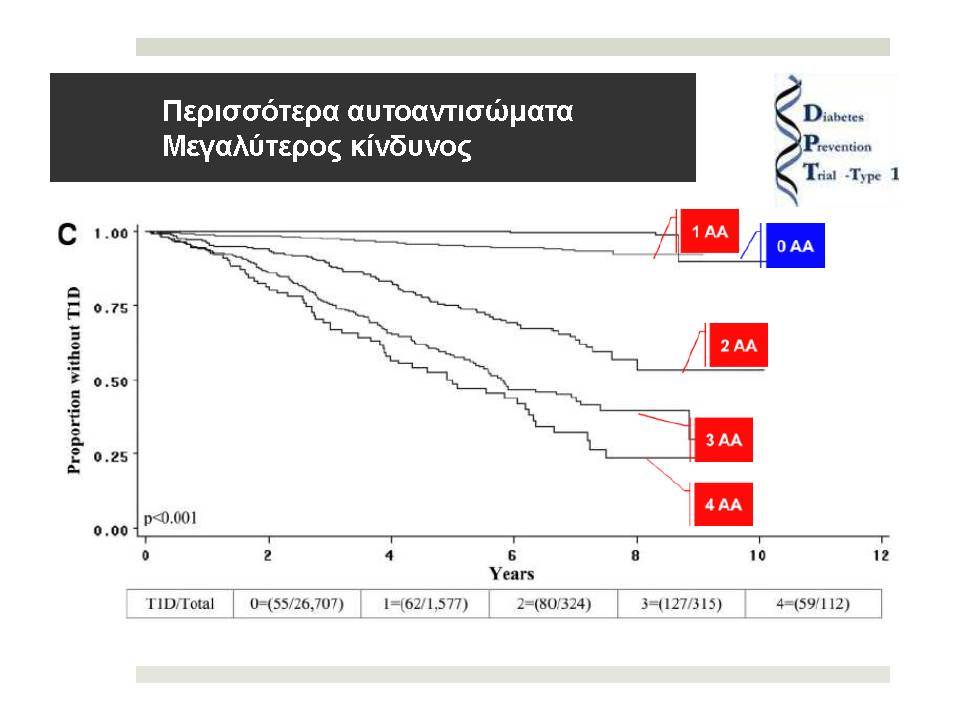
Ο Σακχαρώδης Διαβήτης τύπου 1 (ΣΔτ1, ινσουλινοεξαρτώμενος σακχαρώδης διαβήτης) θεωρείται σήμερα ένα ετερογενές, πολυπαραγοντικό, αυτοανόσου αιτιολογίας νόσημα, στο οποίο η αυτοάνοση διεργασία στρέφεται επιλεκτικά κατά των β-κυττάρων των παγκρεατικών νησιδίων , που παράγουν ινσουλίνη. Για την ανάπτυξη του ανοσολογικού μηχανισμού που καταστρέφει τα β-κύτταρα, απαραίτητη είναι η επίδραση περιβαλλοντικών παραγόντων σε γενετικά προδιατεθειμένα άτομα.
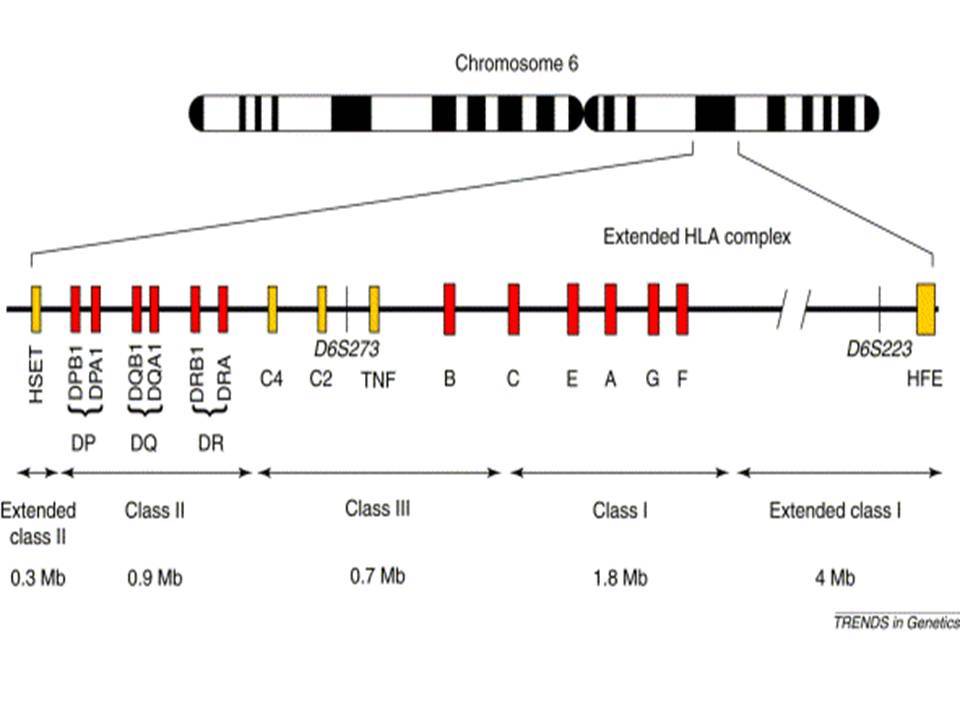
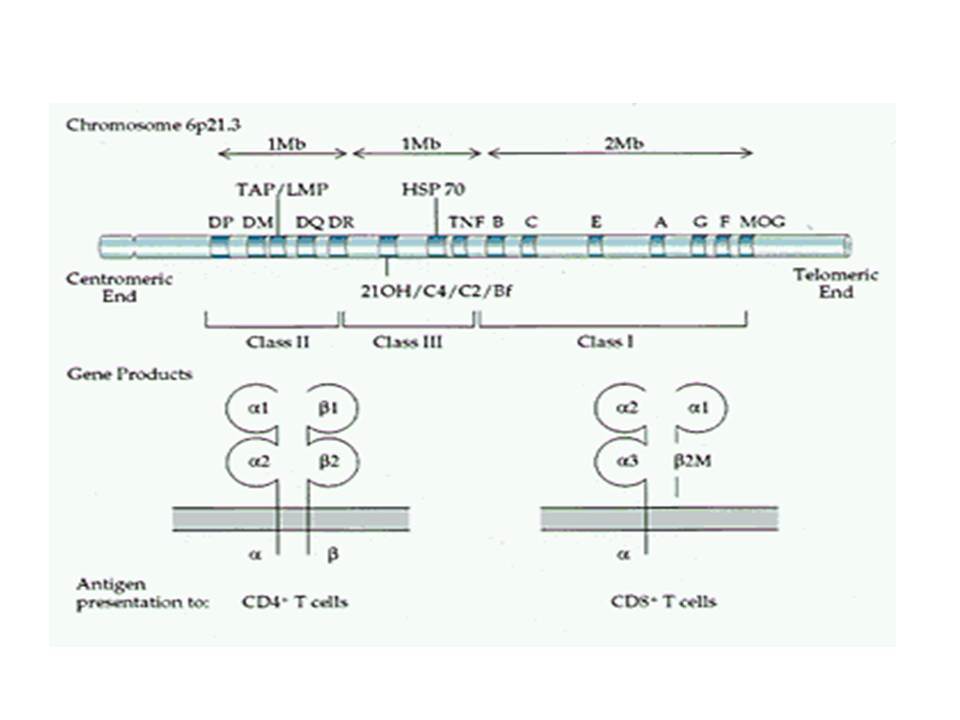
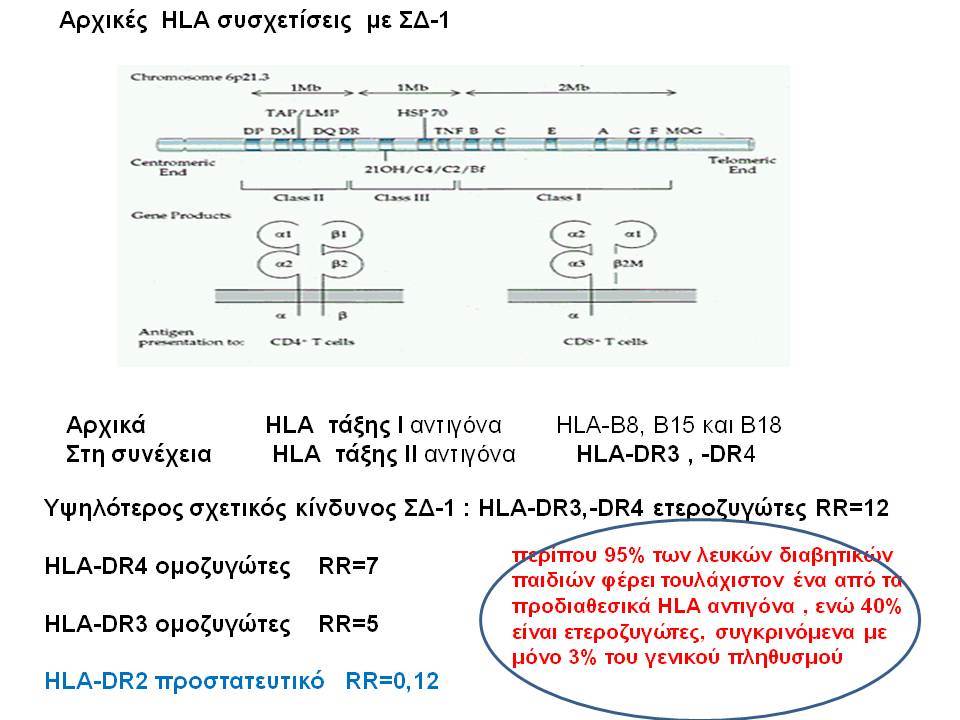
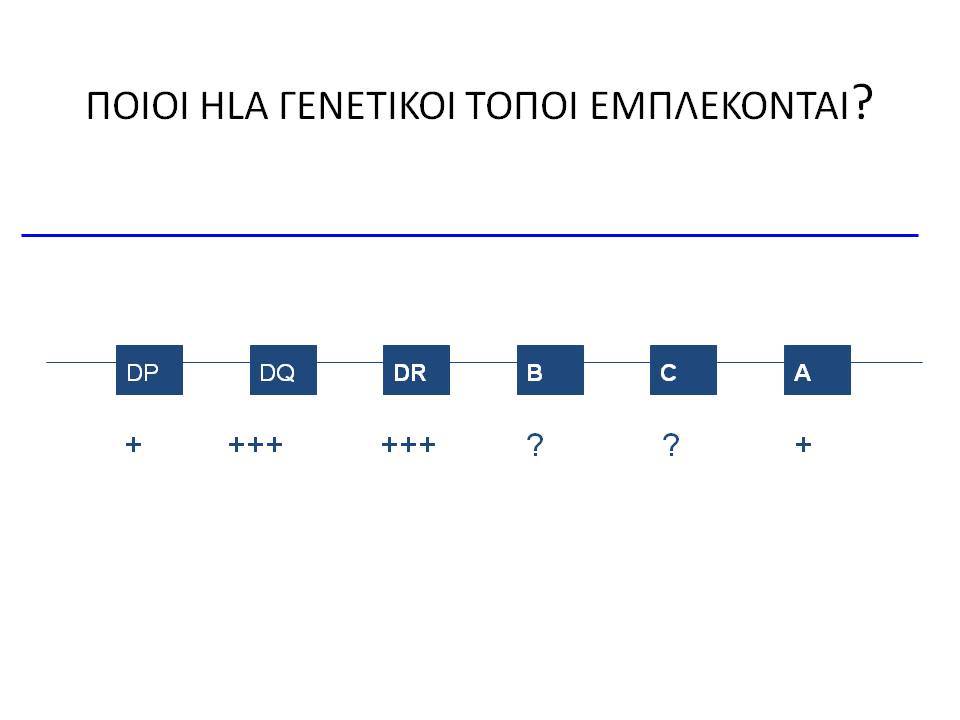
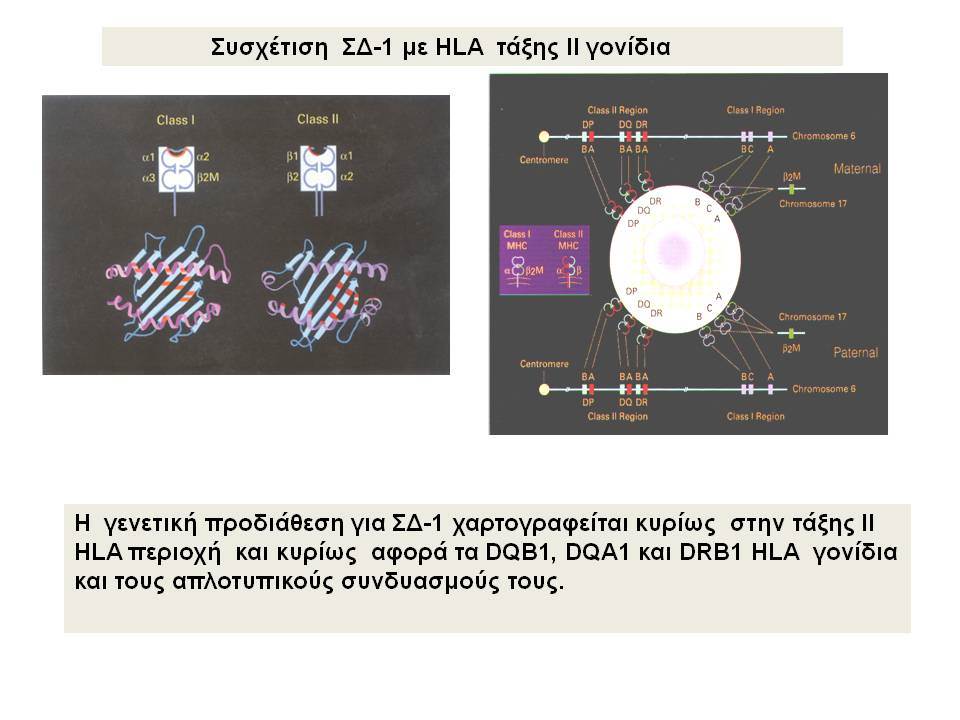
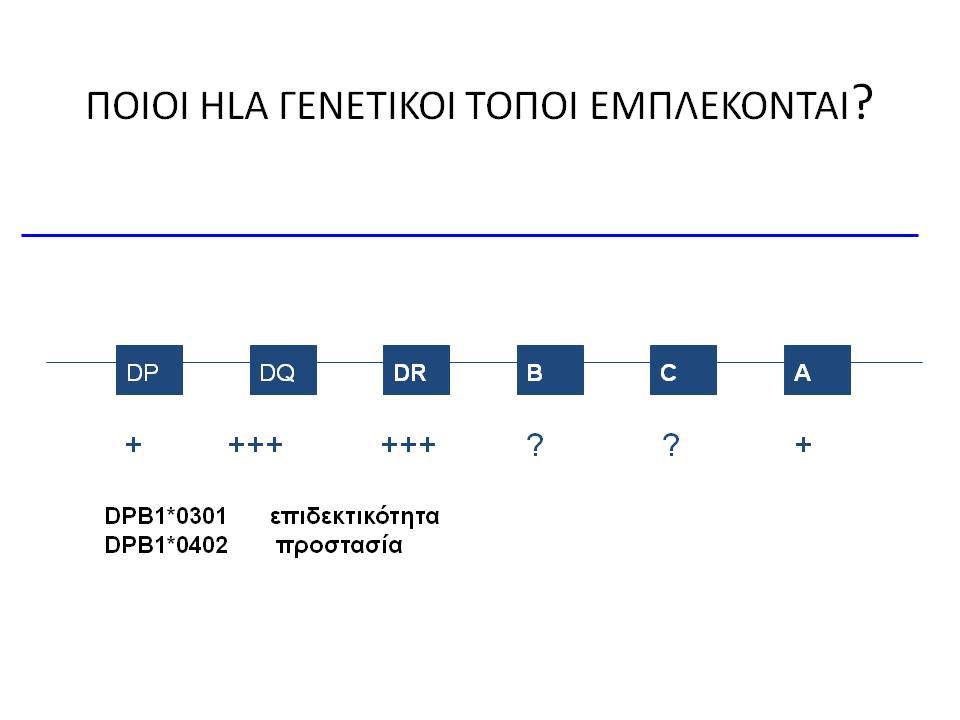
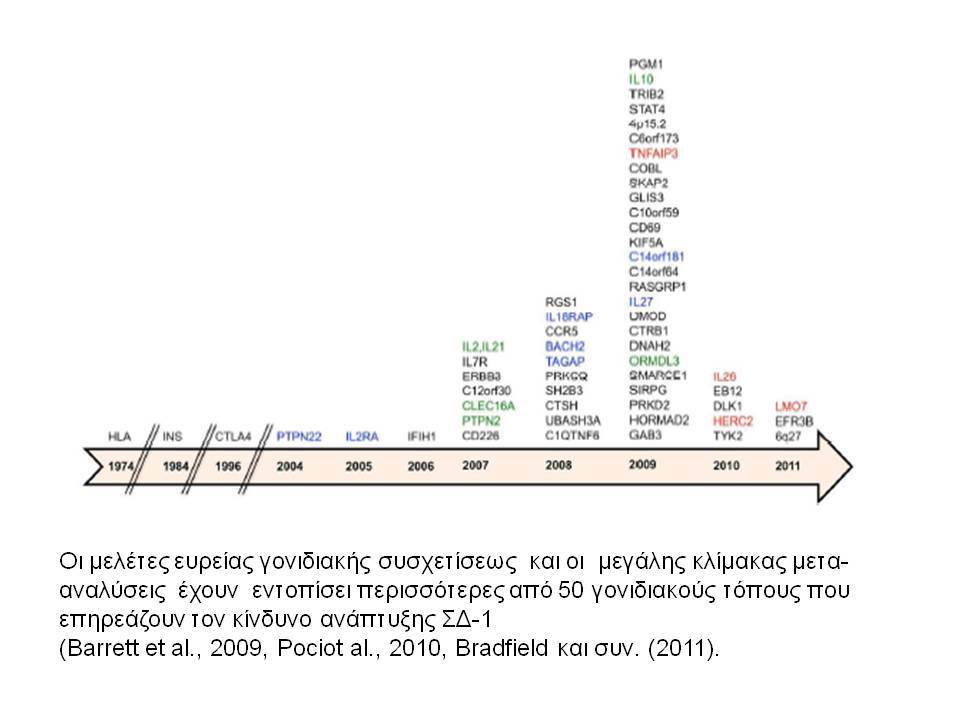
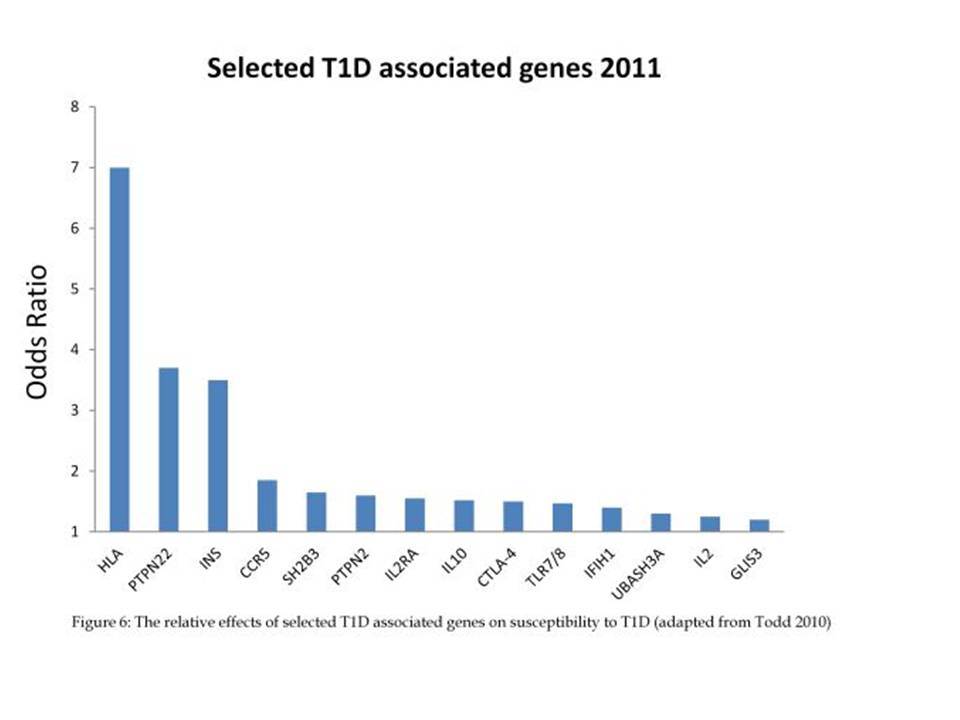
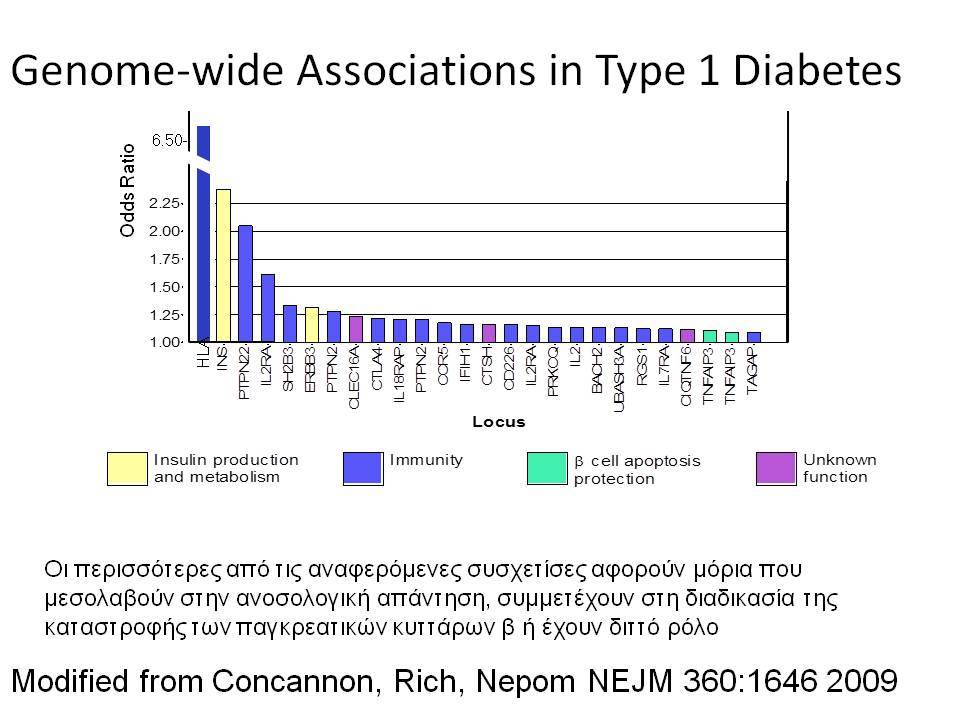
Ο ΣΔτ1 είχε συσχετισθεί αρχικά με τουλάχιστον 20 χρωμοσωμιακές περιοχές, που η ταξινόμηση τους έγινε με βάση το συμβολισμό IDDM-1,2,3 κ.λ.π. σύμφωνα με την επιτροπή ονοματολογίας του ανθρώπινου γονιδιώματος. Η χρωμοσωμική περιοχή που επικράτησε σταθερά και η γενετική της συσχέτιση με ΣΔτ1 τεκμηριώθηκε ανεξάρτητα από όλες τις ερευνητικές ομάδες είναι η HLA περιοχή στο χρωμόσωμα 6 -που ταξινομήθηκε ως IDDM1- με κύρια, αλλά όχι μοναδική, συμμετοχή των HLA-DQΑ,-DQΒ,-DRB1 γονιδιακών θέσεων, καθώς και η περιοχή της ρυθμιστικής αλληλουχίας επαναλήψεων στο 5’ άκρο του γονιδίου της ινσουλίνης στο χρωμόσωμα 11 - που ταξινομήθηκε ως IDDM2. Το μεγαλύτερο μέρος του κληρονομούμενου κινδύνου έχει διαπιστωθεί ότι καθορίζεται από τους γενετικούς τόπους IDDM1 και IDDM2, 42% και 10% αντίστοιχα.
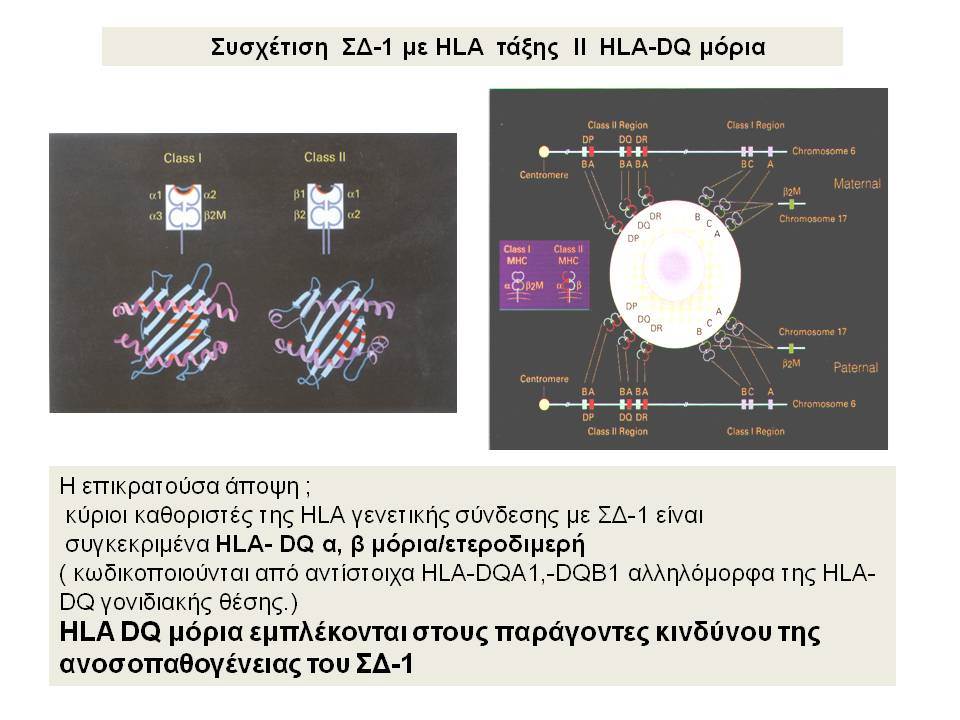
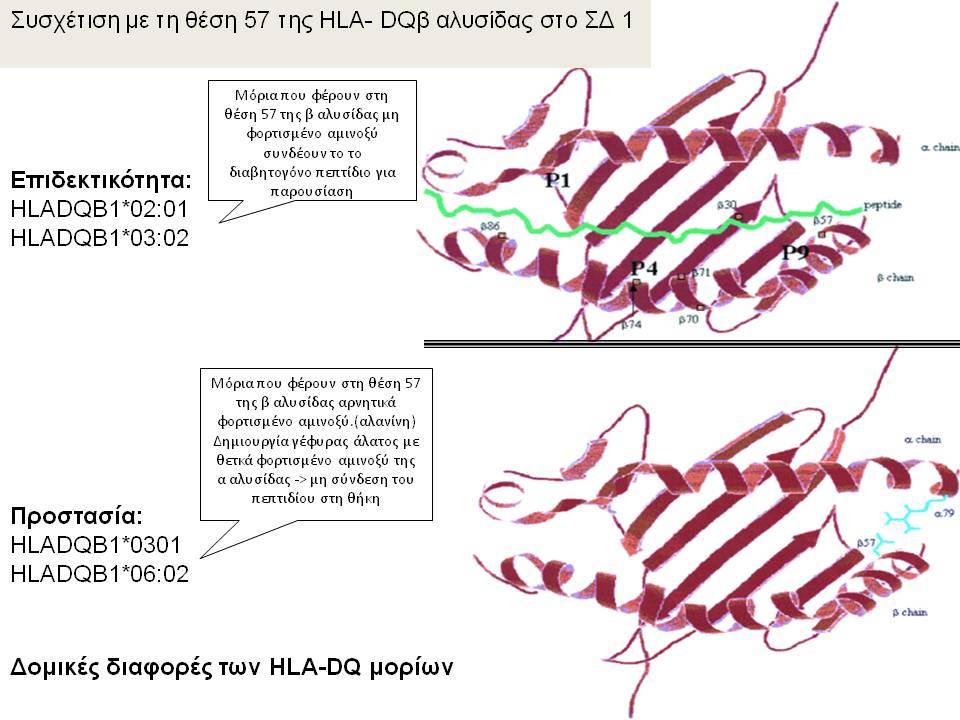
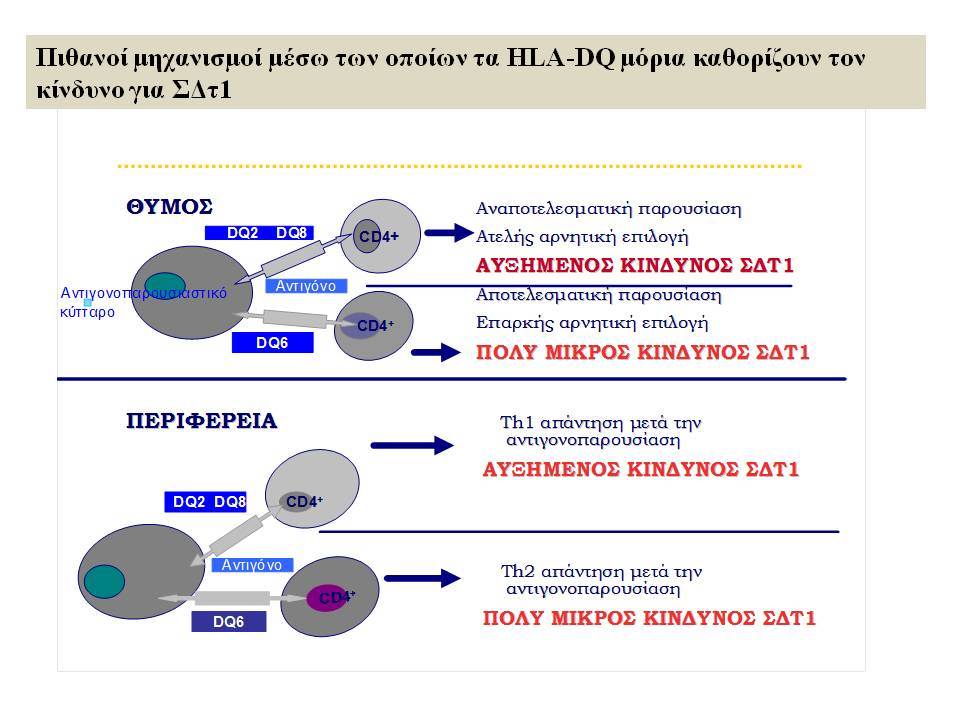
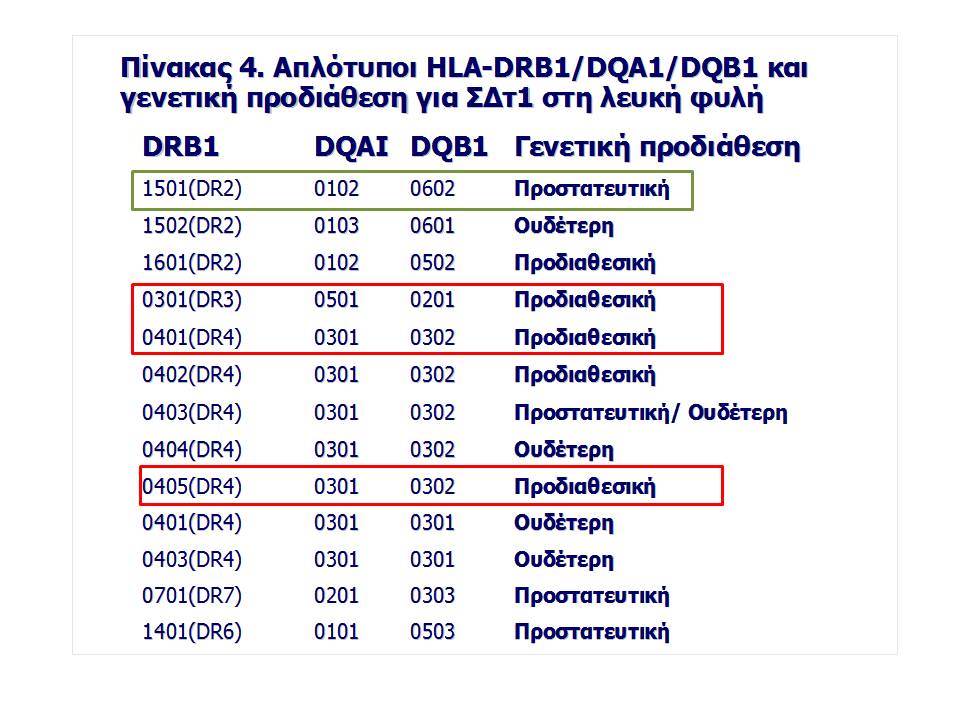
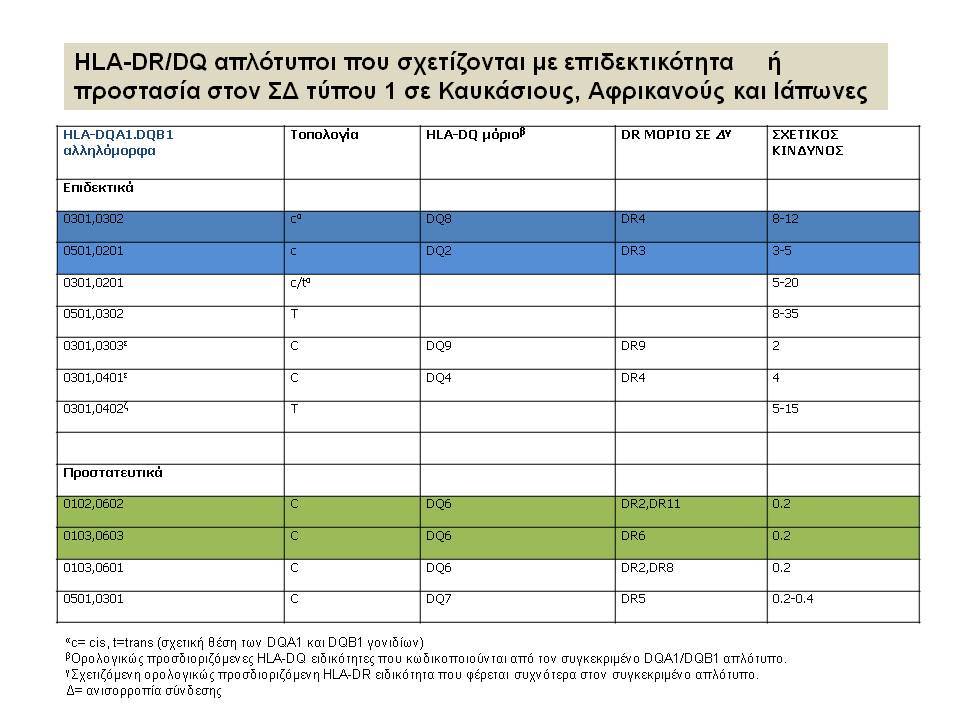
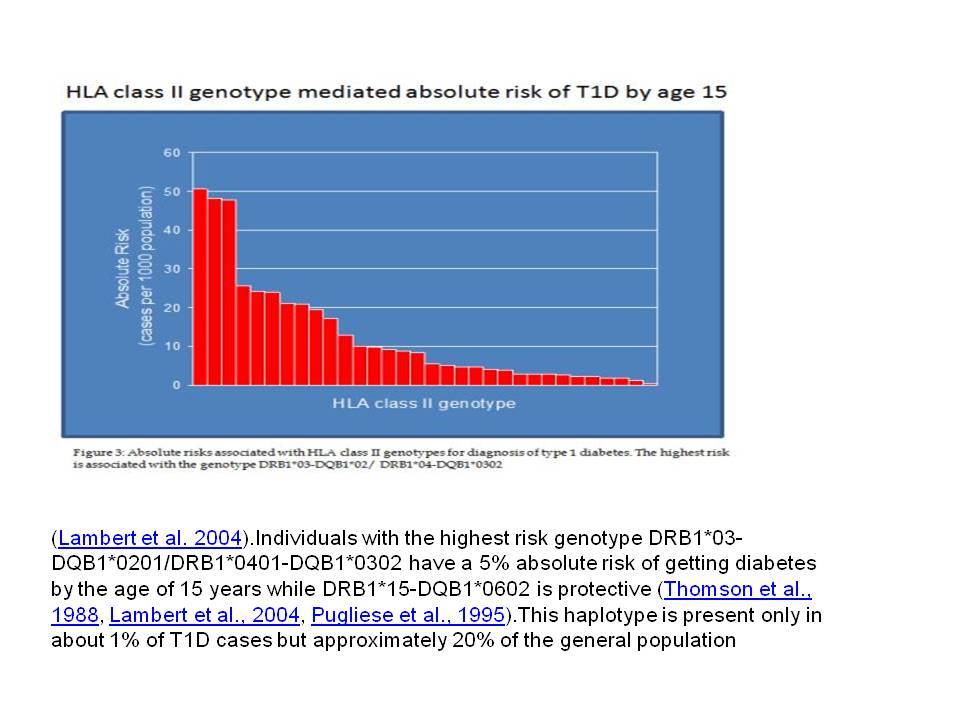
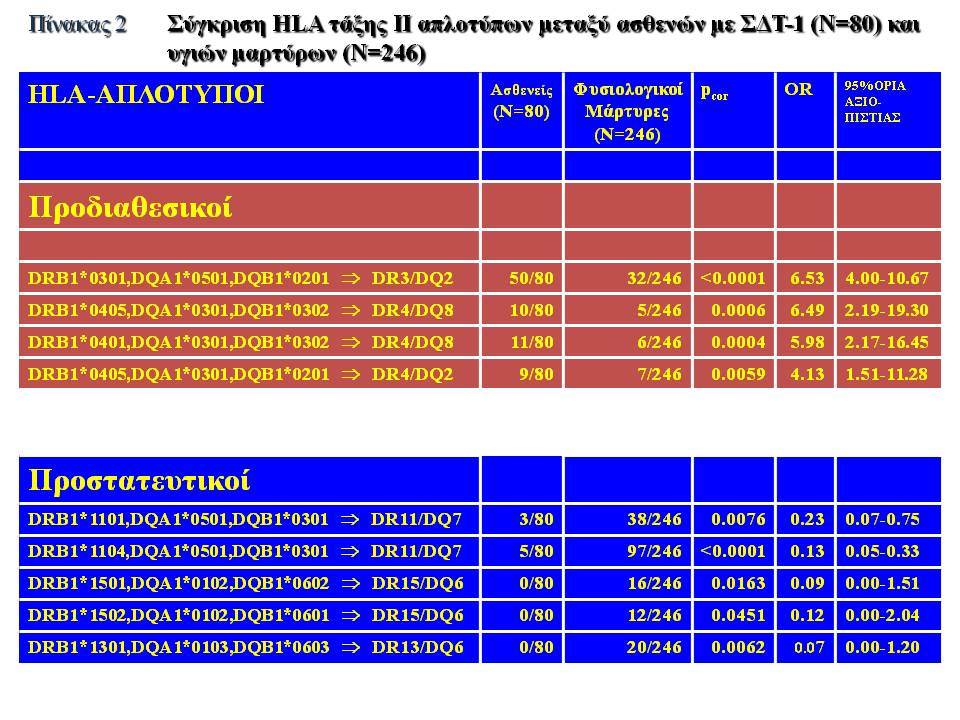
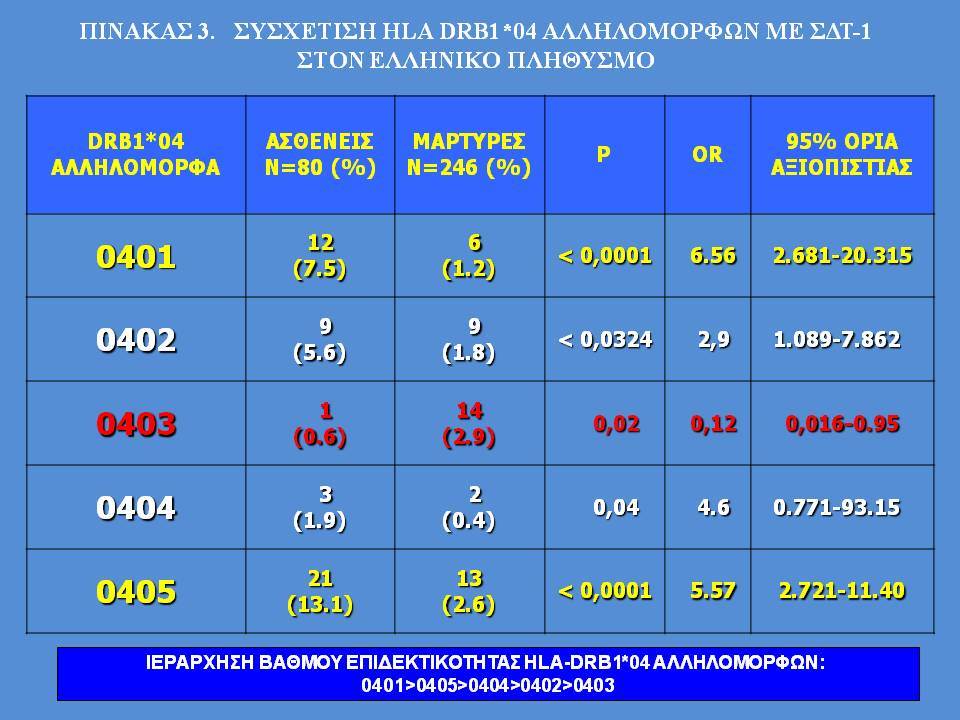
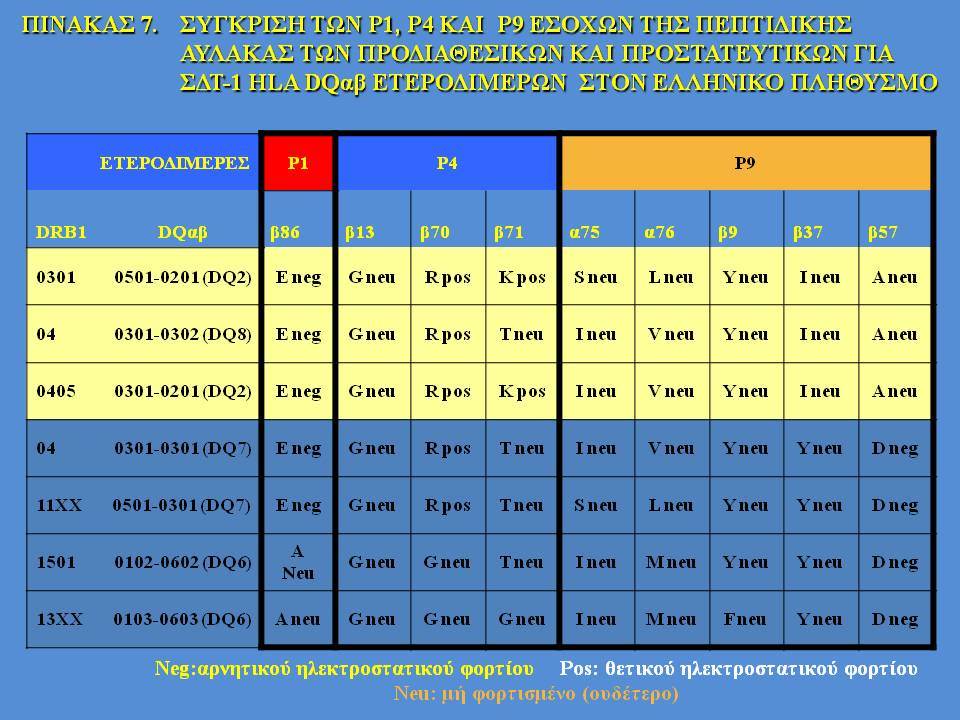
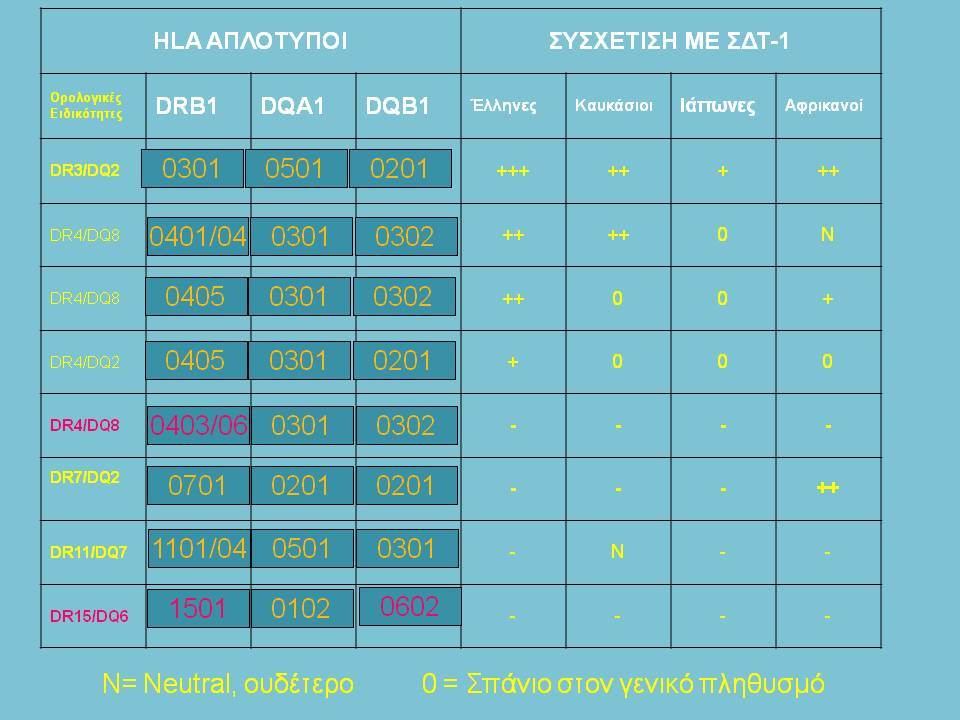
Οι HLA-συσχετίσεις με ΣΔτ1 εμφανίζουν μεγάλη ανομοιογένεια μεταξύ των διαφόρων πληθυσμιακών ομάδων, που οφείλεται τόσο στην διαφορετική κατανομή των HLA αλληλομόρφων στο γενικό πληθυσμό, όσο και στη διαφορετική ανισορροπία σύνδεσης μεταξύ τους. Η επικρατούσα άποψη είναι ότι κύριοι καθοριστές της HLA γενετικής σύνδεσης με ΣΔτ1 θεωρούνται συγκεκριμένα HLA- DQ α,β μόρια (ετεροδιμερή) που κωδικοποιούνται από αντίστοιχα HLA-DQΑ1,-DQΒ1 αλληλόμορφα της HLA-DQ γονιδιακής θέσης. Από τα HLA-DQB αλληλόμορφα,στη Λευκή φυλή, εκείνα που εμφανίζουν την πιο ισχυρή θετική συσχέτιση με ΣΔτ1(επιδεκτικότητα) θεωρούνται τα HLA-DQB1*02:01 (HLA-DQ2) και HLA-DQB1*03:02 (HLA-DQ8), ενώ αρνητική συσχέτιση (προστασία) εμφανίζουν τα HLA-DQB1*06:02 (HLA-DQ6) κυρίως, αλλά και το HLA-DQΒ1*03:01(HLA-DQ7). Βεβαίως το καθένα από αυτά τα γονίδια συμβάλλει και μόνο του στην επιδεκτικότητα για ΣΔτ1 (ο σχετικός κίνδυνος για DQB1*03:02 είναι οκταπλάσιος ενώ για DQB1*02:01 τριπλάσιος ). Αρκετοί ερευνητές διατύπωσαν την άποψη ότι η γενετική προδιάθεση και η αντίσταση στην εμφάνιση ΣΔτ1 εξαρτώνται σε σημαντικό βαθμό από μερικούς συνδυασμούς γονιδίων HLA DQA1/ HLA DQB1 οι οποίοι βρίσκονται είτε σε θέση cis (στον ίδιο απλότυπο) είτε σε θέση trans (σε διαφορετικό απλότυπο). Οσον αφορά τους HLA DR-DQ απλοτυπικούς συνδυασμούς προδιαθεσικοί για εμφάνιση ΣΔτ1 είναι οι HLA DRB1*03:01-DQA1*05:01-DQB1*02:01 ( HLA-DR3/DQ2 ) και DRB1*04-DQA1*03:01-DQB1*03:02 (HLA DR4/ DQ8). Περισσότερο από 90% των ασθενών με ΣΔτ-1 φέρουν τον έναν ή και τους δύο αυτούς απλοτύπους, αν και ο DRB1*03:01-DQA1*05:01-DQB1*02:01 / DRB1*04-DQA1*03:01-DQB1*03:02 (DR3-DQ2/DR4-DQ8) ετερόζυγος συνδυασμός προσδίδει το μεγαλύτερο βαθμό γενετικής προδιάθεσης με τη νόσο. Aντίθετα, όπως έχει διαπιστωθεί, σχεδόν σε όλες τις εθνικές ομάδες, ισχυρή προστασία για εμφάνιση ΣΔτ1 συσχετίζεται με τον HLA DRB1*15:01-DQA1*01:01-DQB1*06:02 απλότυπο (HLA-DR15/DQ6). Η προστασία που προσδίδεται από το DQB1*06:02 αλληλομόρφο φαίνεται να είναι επικρατούσα έναντι των προδιαθεσικών γονιδίων. H επίδραση των αντιγόνων HLA στην γενετική προδιάθεση του ΣΔτ1 προφανώς σχετίζεται με τον κεντρικό ρόλο αυτών των μορίων στην αντιγονοπαρουσίαση και στην ενεργοποίηση των μηχανισμών κυτταρικής ανοσίας.
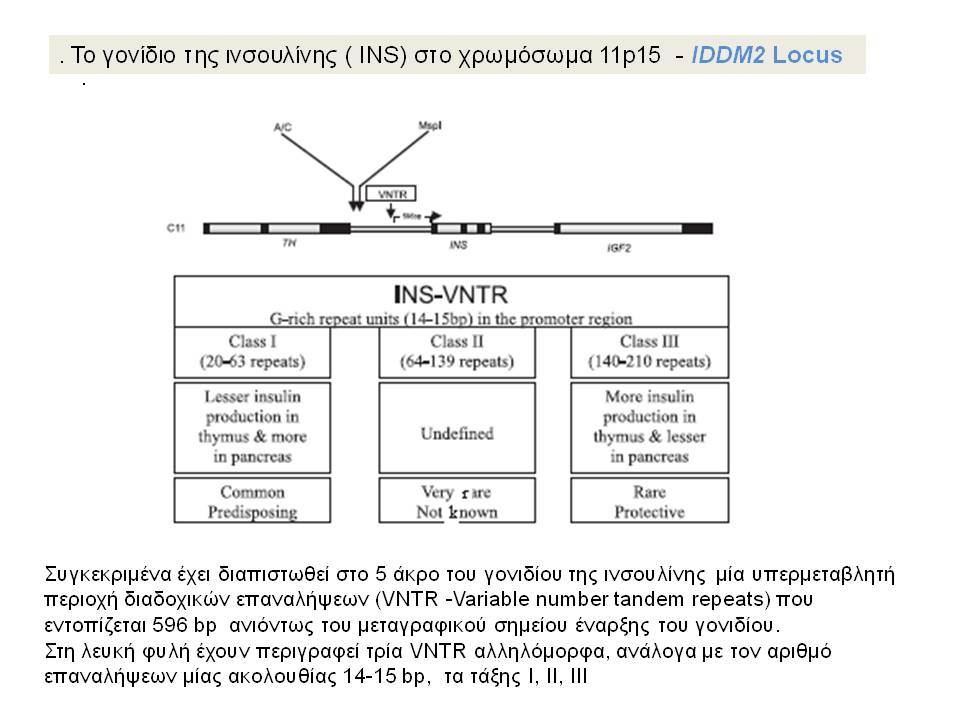
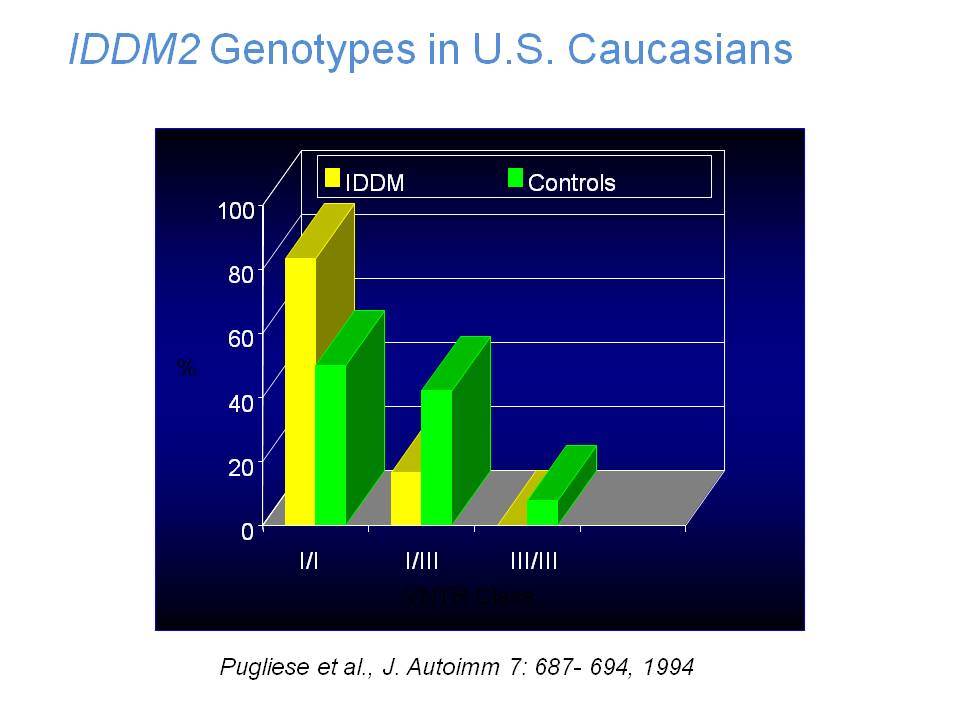
Η ανεπαρκής έκκριση ινσουλίνης που χαρακτηρίζει τον ΣΔτ1 έστρεψε την προσοχή των ερευνητών στη μελέτη του γονιδίου της ινσουλίνης (IDDM2) που εντοπίζεται στα βραχέα σκέλη του χρωμοσώματος 11. Συγκεκριμένα έχει διαπιστωθεί στο 5 άκρο του γονιδίου της ινσουλίνης μία υπερμεταβλητή περιοχή VΝΤR (Variable number tandem repeats) που εντοπίζεται 596 bp ανιόντως του μεταγραφικού σημείου έναρξης του γονιδίου. Στη λευκή φυλή έχουν περιγραφεί τρία VΝΤR αλληλόμορφα, ανάλογα με τον αριθμό επαναλήψεων μίας ακολουθίας 14-15 bp. Μελέτες έδειξαν αυξημένη συχνότητα των τάξης Ι αλληλομόρφων στους πάσχοντες από ΣΔ-1 (0,88) σε σύγκριση με υγιείς μάρτυρες (0,67). Αντίθετα, τα τάξης ΙΙΙ αλληλόμορφα συσχετίσθηκαν με επικρατούσα προστασία, αν και υπάρχουν εξαιρέσεις και στις δύο περιπτώσεις. Πρόσφατες μελέτες οικογενειών με πολλά πάσχοντα μέλη επιβεβαίωσαν τη σύνδεση του γονιδίου της ινσουλίνης με τον ΣΔτ1. Τα VΝΤR αλληλόμορφα φαίνεται ότι έχουν σημασία για την παρουσίαση της ινσουλίνης στο θύμο και την ανάπτυξη ανοσολογικής ανοχής.
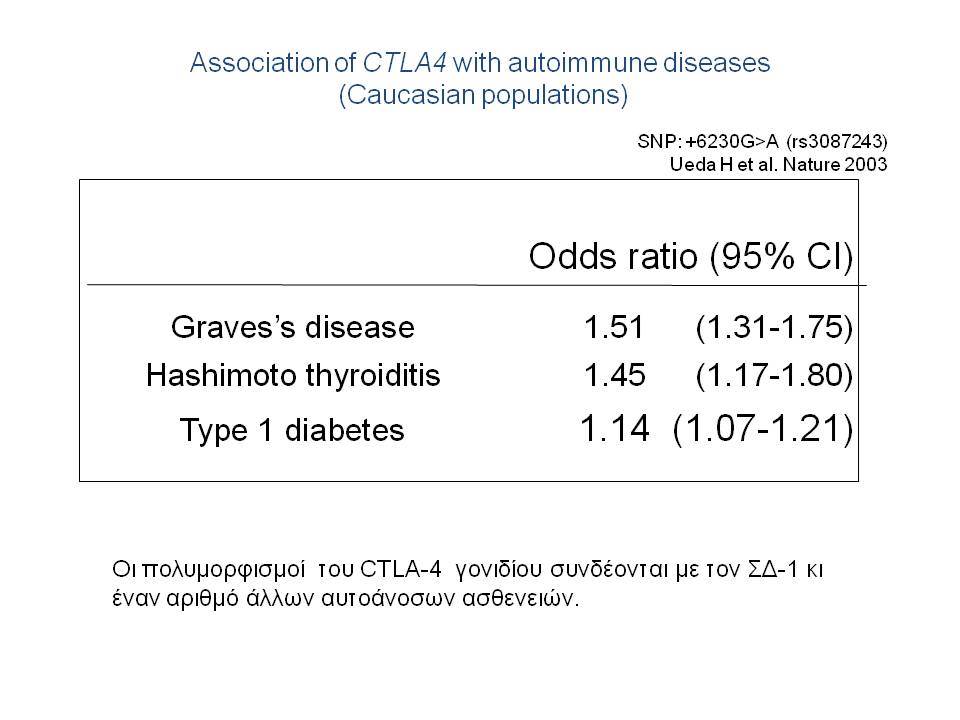
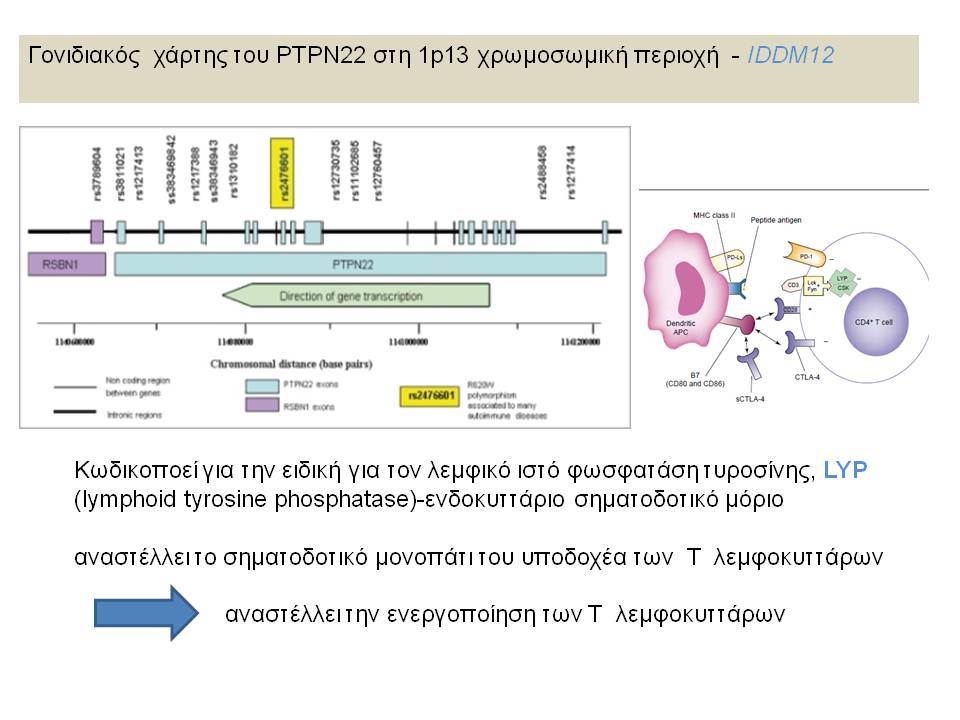
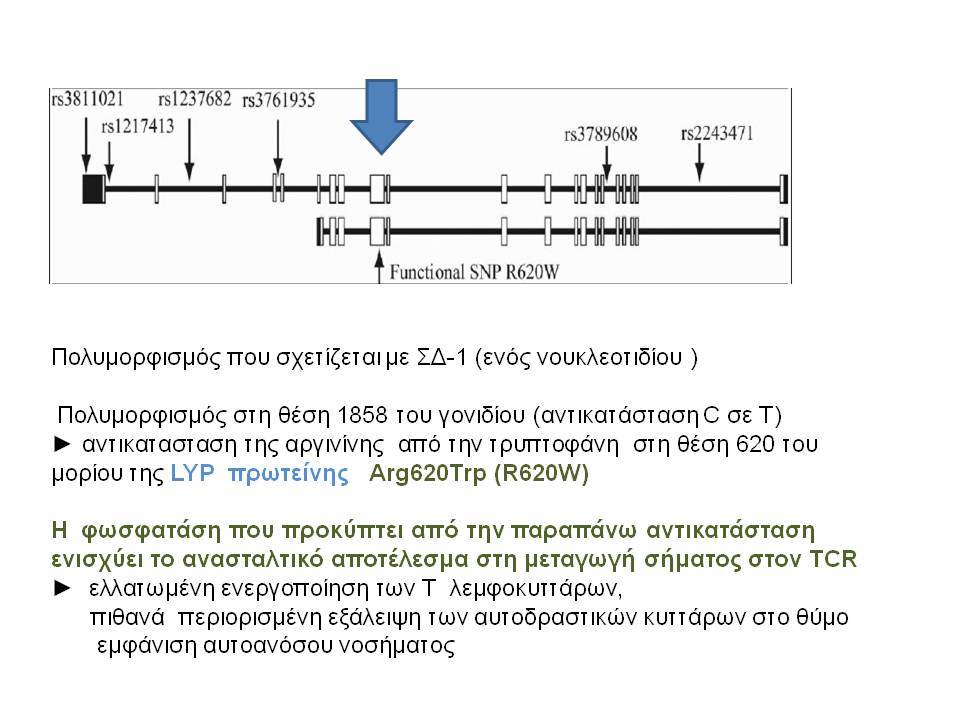
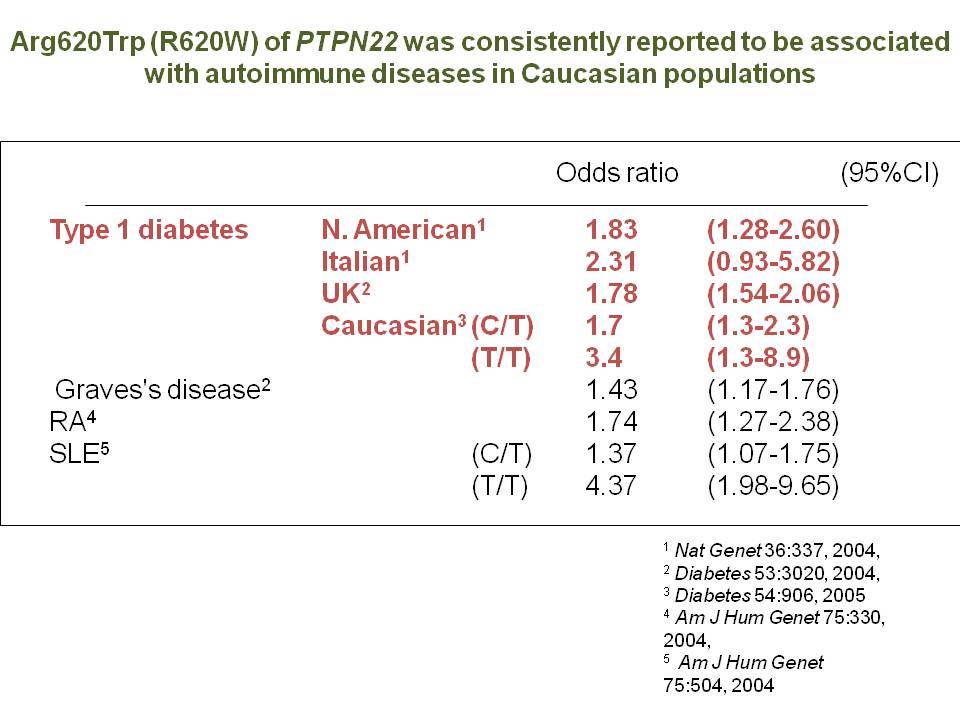
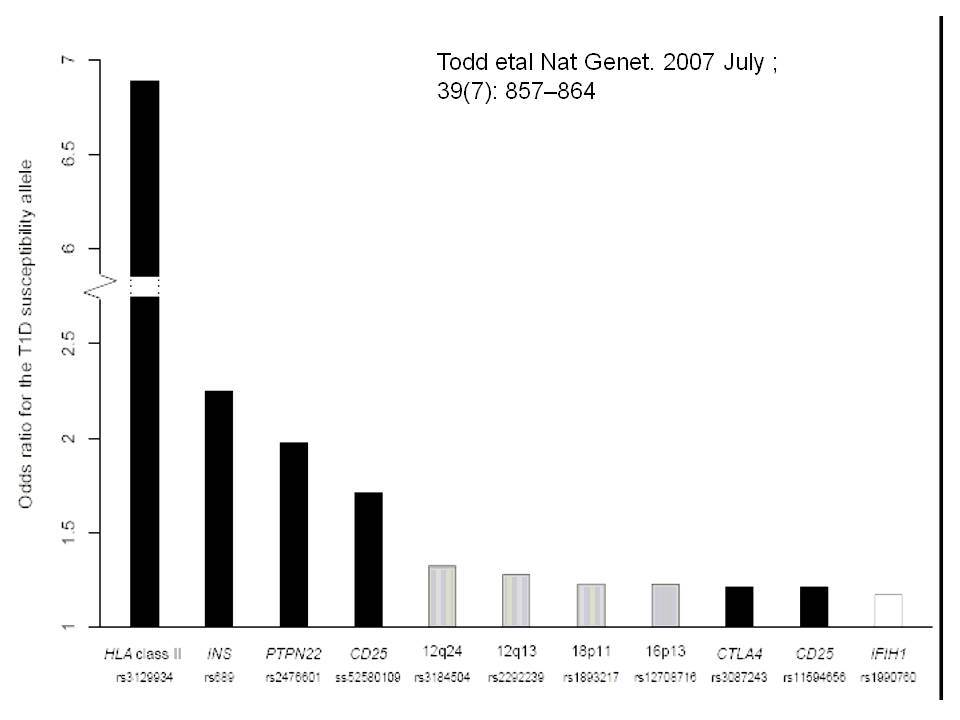
Τελευταία ο ΣΔτ1 έχει συσχετισθεί βάσιμα με δύο ακόμα γενετικούς τόπους, την χρωμοσωμιακή περιοχή 2q33 ( ταξινομήθηκε ως IDDM12) και το γενετικό τόπο PTPN22 (LYP) στο χρωμόσωμα 1p13. Ο γενετικός τόπος IDDM12 περιλαμβάνει ένα άθροισμα γονιδίων που κωδικοποιούν πρωτείνες που συμμετέχουν στην συνδιέγερση των Τ-κυττάρων. Η πρωτείνη CTLA4 (cytotoxic T-lymphocyte-associated 4) έχει σημασία στην ενεργοποίηση των Τ-κυττάρων και έχει επίσης συσχετισθεί με άλλα αυτοάνοσα νοσήματα. Τα αλληλόμορφα CTLA-4 A→G (Thr/Ala) έχει διαπιστωθεί ότι μεταδίδονται με αυξημένη συχνότητα από τους γονείς στα παιδιά με ΣΔτ1, αλλά με σημαντική ετερογένεια στους διαφόρους πληθυσμούς. H γενετική περιοχή PTPN22 κωδικοποεί για την λεμφοειδική πρωτεινική τυροσινική κινάση LYP, η οποία ασκεί αρνητικό έλεγχο στην ενεργοποίηση και στην ανάπτυξη των Τ κυττάρων. Η συσχέτιση πολυμορφισμών της περιοχής αυτής με το ΣΔτ1 έχει διαπιστωθεί σε πολλές μελέτες. Παρόμοιες συσχετίσεις έχουν περιγραφεί και με άλλα αυτοάνοσα νοσήματα.
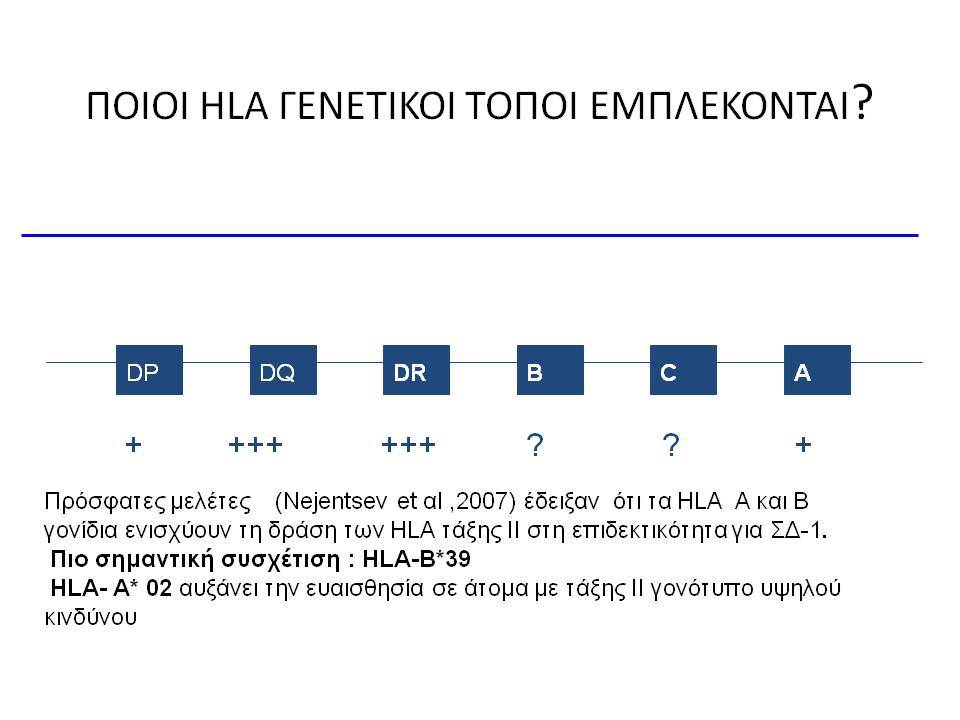
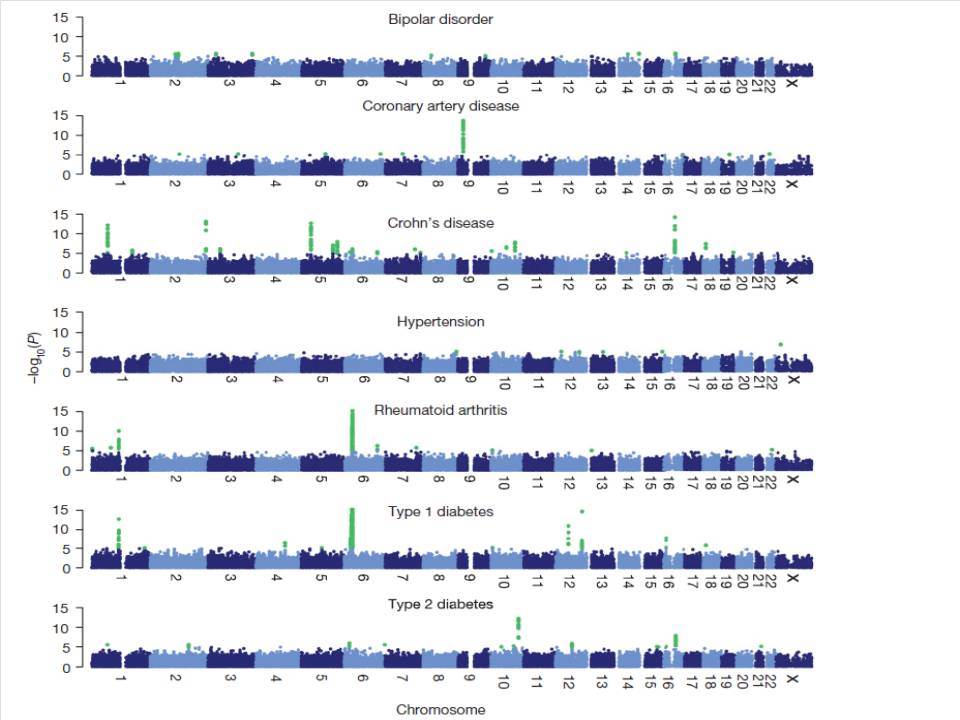
Εντυπωσιακές, όμως, είναι οι εξελίξεις στον τομέα της γενετικής του διαβήτη κατά τα τελευταία χρόνια. Μελέτες ανίχνευσης ολοκλήρου του γονιδιώματος αποκάλυψαν πολλές άλλες χρωμοσωμικές περιοχές να συνδέονται ισχυρά και σταθερά με τον ΣΔτ1 ( ο υποδοχέας της ιντερλευκίνης 2, η πρωτεΐνη Α, σχετιζόμενη με την ubiquitin) .
Η ανίχνευση των ατόμων με αυξημένο γενετικό κίνδυνο σε συνδυασμό με ανοσολογικούς και μεταβολικούς δείκτες, αποτελούν σήμερα την αφετηρία σε όλες τις ερευνητικές προσπάθειες πρόβλεψης και πρόληψης του ΣΔτ1.
Η Μαίρυλιν (Μαρία) Σταυροπούλου-Βλάχου είναι Συντονίστρια Διευθύντρια του Τμήματος Ανοσολογίας-Ιστοσυμβατότητας του Γενικού Νοσοκομείου Αθηνών «ΑΛΕΞΑΝΔΡΑ», συνεργαζόμενη επιστημονική υπεύθυνη του εργαστηρίου Ιστοσυμβατότητας-Ανοσογενετικής της Ελληνικής Τράπεζας Ομφαλοπλακουντιακού Αίματος του ΙΙΒΕΑΑ.
Απόφοιτος Ιατρικής Σχολής Αριστοτελείου Πανεπιστημίου Θεσσαλονίκης. Απόκτηση ειδικότητας Ιατρικής Βιοπαθολογίας στα Νοσοκομεία «Σωτηρία» και «Αλεξάνδρα». Μεταπτυχιακή εκπαίδευση στην Κλινική Ανοσολογία-Αλεργιολογία, στην Immunology Clinic, Ιmmunodiagnostic Lab of Allergic Diseases-Asthma, Knoxville, Tennessee USA -Υπότροφος του Κρατικού Οργανισμού ECFMG. Μετεκπαίδευση στη μοριακή βιολογία/ μοριακή διάγνωση στην Α΄ Παθολογική Κλινική του Παν/μίου Αθηνών, στο Dept. D’ Immunohaematologie Hospital Saint Louis Paris και στο Karolinska University Stokcholm. Εκπόνηση Διδακτορικής Διατριβής στην Α’ Παθολογική Κλινική της Ιατρικής Σχολής του Πανεπιστημίου Αθηνών με θέμα: Συσχέτιση HLA-DQ πολυμορφισμού με γενετική προδιάθεση για Σακχαρώδη Διαβήτη τύπου 1 στον ελληνικό πληθυσμό.
Από το 1989-2009, εργάσθηκε στο Ανοσολογικό Τμήμα/Εθνικό Κέντρο Ιστοσυμβατότητας του Π.Γ.Ν. Αθηνών «Γεώργιος Γεννηματάς» όπου οργάνωσε και λειτούργησε ως επιστημονική υπεύθυνη το εργαστήριο Μοριακής Βιολογίας /Ανοσογενετικής ενώ συγχρόνως συμμετείχε και σε όλες τις κλινικές και ερευνητικές δραστηριότητες του Τμήματος. Συνεργάσθηκε με αρκετά Κέντρα και Εργαστήρια Ιστοσυμβατότητας-Ανοσογενετικής του εξωτερικού. Συμμετείχε με ανακοινώσεις σε περισσότερα από 150 Συνέδρια – Ημερίδες – Συμπόσια, σε 12 ερευνητικά προγράμματα, και ως προσκεκλημένη ομιλήτρια σε πολλές επιστημονικές εκδηλώσεις. Επίσης έχει περισσότερες από πενήντα δημοσιεύσεις, έχει συμμετάσχει στην εκπόνηση 20 διατριβών/μεταπτυχιακών εργασιών, καθώς και στην διοργάνωση αρκετών συνεδρίων/σεμιναρίων Ανοσολογίας-Ιστοσυμβατότητας.
Είναι μέλος πολλών επιστημονικών εταιρειών ελληνικών και διεθνών και αντιπρόεδρος του ΔΣ της Ελληνικής Εταιρείας Ανοσολογίας. Διετέλεσε για μία δεκαετία περίπου Επιθεωρητής Διαπίστευσης Εργαστηρίων Ιστοσυμβατότητας της European Federation of Immunogenetics-EFI. Τα πεδία ιδιαίτερου επιστημονικού ενδιαφέροντος της εστιάζονται στην Ανοσογενετική , Ιστοσυμβατότητα , Ανοσολογία Μεταμοσχεύσεων, Ανοσολογία Αναπαραγωγής , Ανοσολογία καρκίνου.

